一、标准制定背景
核酸检测是新型冠状病毒肺炎疫情诊疗、防控的重要依据,具有灵敏度高、准确度高的特点。2022年4月19日,中国牵头的首个新冠病毒核酸检测国际标准(ISO/TS 5798:2022《体外诊断检验系统——核酸扩增法检测严重急性呼吸系统综合征冠状病毒 2(SARS-CoV-2)的要求及建议》)正式发布。该标准由市场监管总局(标准委)组织华大基因、中国标准化研究院等单位提出并联合美国、德国、日本、加拿大和英国等全球专家共同研制。
该标准是国际标准化组织(ISO)发布的全球首个新冠病毒核酸检测的技术规范,也是国际标准化组织临床实验室检验和体外诊断系统技术委员会(ISO/TC 212)自1994年成立以来,首次发布由中国提出的国际标准。值得一提的是,该标准从立项到发布用时仅16个月,不到两年,成为ISO/TC 212标准发布史上用时最短的非快速程序制定的标准。
二、标准主要技术内容
ISO/TS 5798:2022结合新冠病毒的特点和检测需求,对核酸扩增法的设计、开发、验证、确认和实施提出了技术要求。标准文本内容由引言、前言、主体、附录、参考文献五个部分构成,主体部分共11章,主要包括范围、术语和定义、通用要求、实验室要求、设计与开发、验证、确认、实施、质量保障等章节。
该标准不同于以往的病毒检测标准,更注重和强调应从试验前、中和后全流程的角度规范和要求新冠病毒核酸检测方法的开发和应用。此外,该标准还对逆转录qPCR (RT-qPCR)、逆转录数字PCR (RT-dPCR)和等温扩增法这三种核酸扩增法检测新冠病毒分析试验的步骤进行了规定。同时还对新冠病毒核酸检测的实验环境、设施设备和人员提出了必要的要求。
现对标准中的一些主要技术内容进行解读。
(一)技术流程
该标准基于核酸扩增技术原理,对病毒检测方法的验证和确认提出了要求和建议,要求对病毒检测的全过程进行评价。基于核酸扩增试验的病毒检测过程的质量属性包括但不限于提取程序的性能评估,测试试剂评估以满足最低测试标准,分析特异性的综合评估,检测限度,以及对试剂稳定性进行评价。如图1所示,标准规定了基于核酸扩增法的新冠病毒检测的质量评价工作流程,明确了精确度、检测限、包容性、特异性等综合评价指标和临床证据等。
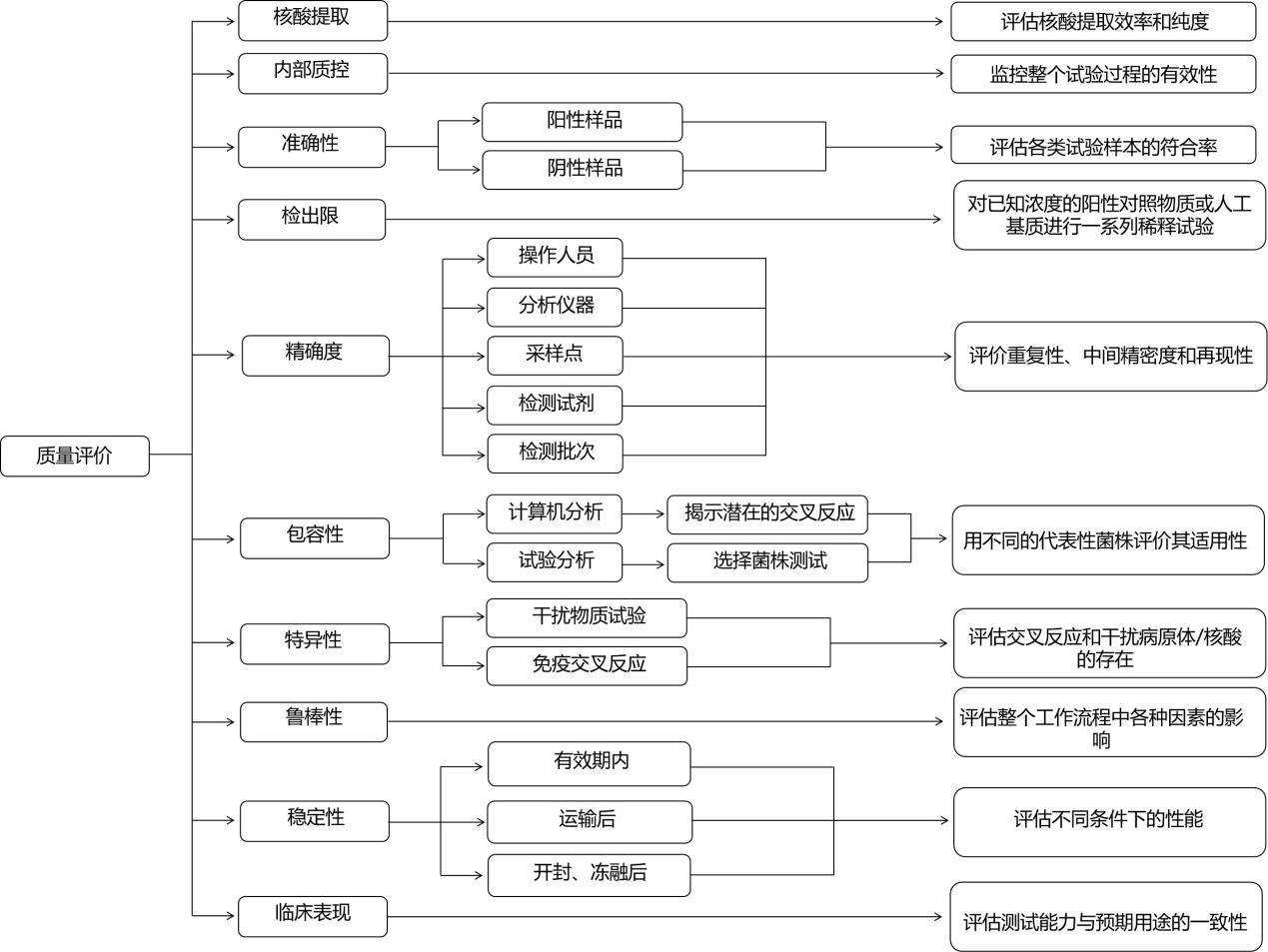
图1 基于核酸扩增法检测新冠病毒的质量评价技术流程
(二)实验室环境要求
标准对新冠病毒核酸检测的实验室的生物安全水平和分区作出了要求。病毒检测实验室应含有一个旨在防止气溶胶污染的工作区域,如适当的生物安全柜和独立的专用工作区域。用于核酸扩增试验检测病毒的实验室应根据当地法规要求达到适当的生物安全水平,至少建议达到生物安全2级。此外,这类实验室应至少有三个物理上独立的房间,一个用于试剂制备,一个用于样品处理,另一个用于核酸扩增试验。
实验室应进行当地风险评估,以确保有能力在适当的风险控制措施下安全地进行预期的检测。应评估实验室服务团队处理新冠病毒相关标本的感染风险能力,以仔细检查工作程序中产生的潜在危险。应完成对所有工作程序、实验室设备和工作场所环境的全面风险评估。产生气溶胶的程序(混合和转移步骤)应在生物安全柜中进行。尽管普通RNA提取试剂盒的外部裂解缓冲液在不加热的情况下可能有效地灭活新冠病毒,但实验室操作中已知或可能被生物制剂污染的任何表面或物质都应正确消毒,以降低感染风险。所有技术程序的执行都应尽量减少气溶胶和飞沫的产生。实验室工作应提供适当的个人防护设备。正确穿戴和脱下个人防护装备的能力以及洗手技术对感染控制也至关重要。
(三)核酸扩增技术的选择
标准要求实验室应根据检测要求和环境选择合适的核酸扩增技术。逆转录qPCR (RT-qPCR)适用于需要对样品进行定性评价或定量的场景,需要qPCR仪,具有较高的分析灵敏度和高通量,操作简单。逆转录数字PCR (RT-dPCR)适用于需要样品绝对定量的场合,需求量小,也适用于贵重样品或核酸降解严重的样品。尽管分析灵敏度高,检测限低,但吞吐量取决于特定的仪器系统。虽然基于PCR的方法被最广泛地用于新冠病毒的检测,但等温扩增方法为检测新冠病毒和识别受感染患者提供了另一种策略。等温扩增方法可以在没有昂贵的热循环设备的情况下使用,并且经常与其他诊断解决方案如CRISPR或DNA测序等结合应用。
(四)操作实施
一旦确认和验证过程完成,应始终将检测纳入工作程序和实验室质量管理体系实施。在病毒进化过程中,应根据突变风险重新评估检测方法。与任何病原体一样,新冠病毒的遗传变异可能会在时间和地理上有所不同,并可能影响核酸扩增检测的性能。在感染过程中,所产生的表型变化可能导致病毒负担或趋向性的差异,进而影响管线诊断系统。因此,遗传变异的影响应作为常规测试评估的一部分进行监测。此外,作为直接测量遗传物质的核酸扩增作为最后一个分子步骤,任何在引物或探针结合处发生的遗传变化也会影响临床标本的检测性能。重新评估应包括与人类基因、冠状病毒科其他成员和其他呼吸道病毒或细菌的交叉反应。
(五)对照品
标准要求对照品的检测应参考当地和国家法规和制造商的使用说明。试验验证中使用的所有材料都应根据已建立的国际标准或参考物质进行校准。当使用这些信息系统或基准材料时,校准器和控制材料的值应该可计量的。无论在验证或评价试验时是否有标准品,每一种标准品的结果都应满足阴性(或无模板对照)和阳性标准品的预先定义的规格。阴性对照应始终包括检测样本中,应包括若干阴性对照,并将其制备与检测样品的制备穿插在一起,以获得分析过程中污染水平的代表性估计。
三、标准实施意义
1、标准全面构建了病毒检测的质量体系,为病毒检测的质量控制提供了标准化手段。标准建立了病毒检测方法全流程的质量控制体系,对病毒检测方法的设计、开发、实施到生产提出了要求和建议;对检测前(样本类型选择、采集、包装、运输和储存等);检测中(个人防护装备、避免交叉污染等);检测后(剩余临床样本的保存和处理、检测报告、实验室的清洁和去污等)的工作提出了要求和建议,不仅覆盖了病毒检测的全流程,还覆盖了病毒检测方法开发的全流程。
2、标准提出了病毒检测方法性能的质量评估体系,基于核酸扩增技术原理,对病毒检测方法的验证和确认提出了要求和建议,明确了精确度、检测限、包容性、特异性等综合评价指标和临床证据等。
3、标准规范了病毒检测方法应用实施的质量保障体系,对新冠病毒检测过程的实验室环境、设施设备、人员及对照品的质量规范也提出了要求。
该标准规范了新冠病毒检测方法的开发基本流程,为全球新冠病毒核酸检测的设计开发、验证及确认提供了更明确、清晰的要求和建议,全面构建了新冠病毒检测的质量体系,为新冠病毒检测的质量控制提供了标准化手段。标准实施将解决全球新冠检测质量评价指标不统一的问题,确保新冠病毒检测试剂的有效性,给试剂制造商提供了产品质量要求的基本遵循,也为全球医学实验室、体外诊断检测试剂开发人员及研究机构提供技术依据,分享我国核酸检测的先进技术成果和成功经验,为促进全球疫情防控发挥积极作用。
文章作者:赵琳、吴琦、吴希、云振宇 中国标准化研究院农业食品标准化研究所
转载请注明出处